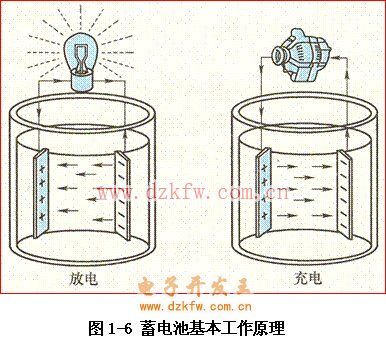
普通蓄電池的工作過程是一個化學(xué)能與電能相互轉(zhuǎn)化的過程。當蓄電池的化學(xué)能轉(zhuǎn)化為電能而向外供電時,稱為放電過程;
當蓄電池與外界電源相聯(lián)而將電能轉(zhuǎn)化為化學(xué)能儲存起來時,稱為充電過程。如圖1-6所示:
1.電動勢的建立
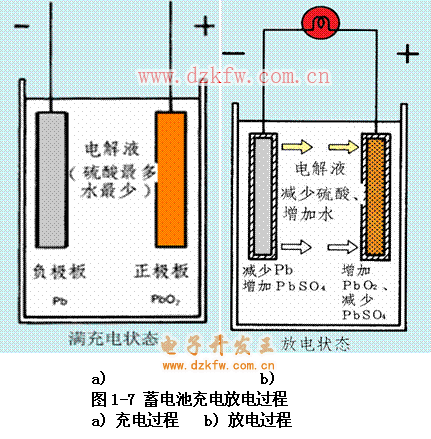
正極板上二氧化鉛電離為正四價鉛離子和負二價氧離子,鉛離子附著在正極板上,氧離子進入電解液中,使正極板具有2.0V的正電位;負極板上的純鉛電離為正二價鉛離子和兩個電子,鉛離子進入電解液中,電子留在負極板上,使負極板具有-0.1的負電位。因此,正、負極板間有2.1V的電位差。
2.放電過程
在電位差的作用下,電流從正極流出,經(jīng)過燈泡流回負極,使燈泡發(fā)光。正極板上的正四價鉛離子與電子結(jié)合生成正二價鉛離子,進入電解液再與硫酸根離子結(jié)合生成硫酸鉛(附著在正極板上);負極板上,正二價鉛離子也同硫酸根離子結(jié)合生成硫酸鉛(附著在負極板上)(圖1-7)。
結(jié)論:
1)放電過程中,正極板上的正四價鉛離子得電子成為正二價鉛離子,并與硫酸根離子生成硫酸鉛附著在正極板上;負極板上的鉛失去電子成為正二價鉛離子,并與硫酸根離子生成硫酸鉛,附著在負極板上。
3)隨著放電過程的進行,電解液中的硫酸根離子不斷與正、負極板上的鉛離子生成硫酸鉛而附著在極板上,使得電解液中的硫酸根離子逐漸減少。同時,由于正極板上負二價氧離子與氫離子生成水,電解液中的水不斷增多,結(jié)果使得電解液的密度不斷下降。
3.充電過程
充電時,外接直流電源的正極接蓄電池的正極板,電源的負極接蓄電池的負極板。當直流電源的電動勢高于蓄電池的電動勢時,電流將以放電電流相反的方向流過蓄電池。
正極板上,正二價鉛離子失去2個電子而成為正四價鉛離子,再與水反應(yīng)生成二氧化鉛,附著在正極板上,電位升高;
負極板上,正二價鉛離子得到2個電子生成一個鉛分子而附著在負極板上;
從正、負極板上電離出來的硫酸根離子與水中的氫離子結(jié)合生成硫酸。
結(jié)論:
1)充電過程中,正極板上的正二價鉛離子失電子成為正四價鉛離子,電位上升;負極板上的正二價鉛離子得到電子成為鉛分子,電位降低。正、負極板間的電位差加大。
2)隨著充電過程的進行,極板上的的硫酸根離子不斷不斷進入電解液與氫離子生成硫酸,使得電解液中的硫酸根離子逐漸增多,結(jié)果使得電解液的密度不斷升高。


 返回頂部
返回頂部 刷新頁面
刷新頁面 下到頁底
下到頁底