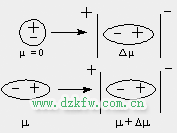
分子間作用力的本質是什么?分子間作用力的本質是物質之間的電磁相互作用。
在物質中,分子是由帶有正電荷和負電荷的原子組成的。這些電荷在分子中形成電場,導致分子之間發(fā)生相互作用。
分子間作用力包括范德華力、氫鍵、離子鍵等,它們都源于分子中的電荷分布和電子云的極化效應。
范德華力是由于分子中電子云的瞬時偶極矩導致的瞬時吸引力,氫鍵是由于分子中氫原子和帶有電負性的原子之間的電荷相互作用導致的吸引力,離子鍵則是由于帶正電荷的離子和帶負電荷的離子之間的電荷相互作用而產生的強力。
總之,分子間作用力的本質是物質中帶有電荷的分子之間相互作用的結果,這種相互作用可以解釋物質的很多性質和現象,例如物質的相態(tài)轉變、分子的凝聚、分子的反應等。
分子間作用力
一.分子間偶極矩
二 分子間作用力——范德華力
化學鍵的結合能一般在 1.0×102kJ/mol 數量級, 而分子間力的能量只有幾個 kJ/mol.
1.取向力
極性分子之間靠永久偶極-永久偶極作用稱為取向力.僅存在于極性分子之間.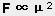
2. 誘導力
誘導偶極與永久偶極作用稱為誘導力.
極性分子作用為電場, 使非極性分子產生誘導偶極或使極性分子的偶極增大(也產生誘導偶極), 這時誘導偶極與永久偶極之間形成誘導力, 因此誘導力存在于極性分子與非極性分子之間, 也存在于極性分子與極性分子之間.
3、色散力
瞬間偶極-瞬間偶極之間有色散力.
由于各種分子均有瞬間偶極, 故色散力存在于極性分子-極性分子、極性分子-非極性分子及非極性分子-非極性分子之間. 色散力不僅存在廣泛, 而且在分子間力中, 色散力經常是重要的. 觀察下面數據:
kJ/mol 取向力 誘導力 色散力
Ar 0 0 8.49
HCl 3.305 1.104 16.82
取向力、誘導力和色散力統(tǒng)稱范德華力, 它具有以下的共性:
1) 永遠存在于分子之間;
2) 力的作用很小;
3) 無方向性和飽和性;
4) 是近程力,
5) 經常是色散力為主.
He Ne Ar Kr Xe
從左到右原子半徑(分子半徑)依次增大, 變形性增大, 色散力增強, 分子間結合力增大, 故 b.p. 依次增高. 可見, 范德華力的大小與物質的 m.p.、b.p. 等物理性質有密切聯系.
1.取向力
極性分子之間靠永久偶極-永久偶極作用稱為取向力.僅存在于極性分子之間.
2. 誘導力
誘導偶極與永久偶極作用稱為誘導力.
極性分子作用為電場, 使非極性分子產生誘導偶極或使極性分子的偶極增大(也產生誘導偶極), 這時誘導偶極與永久偶極之間形成誘導力, 因此誘導力存在于極性分子與非極性分子之間, 也存在于極性分子與極性分子之間.
3、色散力
瞬間偶極-瞬間偶極之間有色散力.
由于各種分子均有瞬間偶極, 故色散力存在于極性分子-極性分子、極性分子-非極性分子及非極性分子-非極性分子之間. 色散力不僅存在廣泛, 而且在分子間力中, 色散力經常是重要的. 觀察下面數據:
kJ/mol 取向力 誘導力 色散力
Ar 0 0 8.49
HCl 3.305 1.104 16.82
取向力、誘導力和色散力統(tǒng)稱范德華力, 它具有以下的共性:
1) 永遠存在于分子之間;
2) 力的作用很小;
3) 無方向性和飽和性;
4) 是近程力,
5) 經常是色散力為主.
He Ne Ar Kr Xe
從左到右原子半徑(分子半徑)依次增大, 變形性增大, 色散力增強, 分子間結合力增大, 故 b.p. 依次增高. 可見, 范德華力的大小與物質的 m.p.、b.p. 等物理性質有密切聯系.
三 氫鍵
1. 氫鍵的概念
以 HF 為例, F 的電負性相當大, 電子對偏向 F, 而 H 幾乎成了質子, 這種 H 與其它分子中電負性相當大、r 小的原子相互接近時, 產生一種特殊的分子間力 —— 氫鍵. 表示為···· : F-H····F-H
兩個條件: 1.與電負性大且 r 小的原子(F, O, N)相連的 H ; 2. 在附近有電負性大, r 小的原子(F, O, N).
2. 氫鍵的特點
1°飽和性和方向性
由于 H 的體積小, 1 個 H 只能形成一個氫鍵.由于 H 的兩側電負性極大的原子的負電排斥, 使兩個原子在 H 兩側呈直線排列. 除非其它外力有較大影響時, 才可能改變方向.
2°氫鍵的強度
介于化學鍵和分子間作用力之間, 和電負性有關.
F-H ···· F O — H ···· O N-H····N
E/kJ·mol-1 28.0 18.8 5.4
3. 氫鍵對于化合物性質的影響
分子間存在氫鍵時, 大大地影響了分子間的結合力, 故物質的熔點、沸點將升高. CH3CH2-OH 存在分子間氫鍵,而分子量相同的 H3C-O-CH3 無氫鍵,故前者的 b.p. 高。
HF、HCl、HBr、HI , 從范德華力考慮, 半徑依次增大, 色散力增加, b.p. 高, 故 b. P. 為 HI > HBr > HCl, 但由于 HF 分子間有氫鍵,故 HF 的b.p. 在這里最高, 破壞了從左到右 b.p. 升高的規(guī)律. H2O, NH3 由于氫鍵的存在, 在同族氫化物中 b.p. 亦是最高.
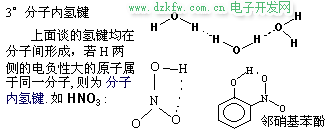
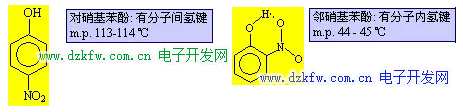
H2O 和 HF 的分子間氫鍵很強, 以致于分子發(fā)生締合, 以(H2O)2、 (H2O)3、(HF)2、(HF)3 形式存在, 而 (H2O)2 排列最緊密, 4℃時, (H2O)2 比例最大, 故 4℃ 時水的密度最大. 可以形成分子內氫鍵時, 勢必削弱分子間氫鍵的形成. 故有分子內氫鍵的化合物的沸點、熔點不是很高.典型的例子是對硝基苯酚和鄰硝基苯酚:
以 HF 為例, F 的電負性相當大, 電子對偏向 F, 而 H 幾乎成了質子, 這種 H 與其它分子中電負性相當大、r 小的原子相互接近時, 產生一種特殊的分子間力 —— 氫鍵. 表示為···· : F-H····F-H
兩個條件: 1.與電負性大且 r 小的原子(F, O, N)相連的 H ; 2. 在附近有電負性大, r 小的原子(F, O, N).
2. 氫鍵的特點
1°飽和性和方向性
由于 H 的體積小, 1 個 H 只能形成一個氫鍵.由于 H 的兩側電負性極大的原子的負電排斥, 使兩個原子在 H 兩側呈直線排列. 除非其它外力有較大影響時, 才可能改變方向.
2°氫鍵的強度
介于化學鍵和分子間作用力之間, 和電負性有關.
F-H ···· F O — H ···· O N-H····N
E/kJ·mol-1 28.0 18.8 5.4

3. 氫鍵對于化合物性質的影響
分子間存在氫鍵時, 大大地影響了分子間的結合力, 故物質的熔點、沸點將升高. CH3CH2-OH 存在分子間氫鍵,而分子量相同的 H3C-O-CH3 無氫鍵,故前者的 b.p. 高。
HF、HCl、HBr、HI , 從范德華力考慮, 半徑依次增大, 色散力增加, b.p. 高, 故 b. P. 為 HI > HBr > HCl, 但由于 HF 分子間有氫鍵,故 HF 的b.p. 在這里最高, 破壞了從左到右 b.p. 升高的規(guī)律. H2O, NH3 由于氫鍵的存在, 在同族氫化物中 b.p. 亦是最高.
H2O 和 HF 的分子間氫鍵很強, 以致于分子發(fā)生締合, 以(H2O)2、 (H2O)3、(HF)2、(HF)3 形式存在, 而 (H2O)2 排列最緊密, 4℃時, (H2O)2 比例最大, 故 4℃ 時水的密度最大. 可以形成分子內氫鍵時, 勢必削弱分子間氫鍵的形成. 故有分子內氫鍵的化合物的沸點、熔點不是很高.典型的例子是對硝基苯酚和鄰硝基苯酚:





 返回頂部
返回頂部 刷新頁面
刷新頁面 下到頁底
下到頁底